¿Qué es la dureza del agua?
La dureza del agua es básicamente la suma de las concentraciones de calcio y magnesio
en el agua, expresada en ppm (partes por millón) de CaCO3. El calcio y el magnesio son
nutrientes esenciales para las plantas, y una concentración adecuada de ellos en el agua
es beneficiosa. Sin embargo, cuando la dureza del agua es demasiado alta, una
precipitación de sales de calcio y magnesio puede ocurrir en el sistema de riego, dañarlo
o reducir su eficiencia. Una dureza demasiado baja puede causar corrosión en el sistema
de riego.
La unidad más común para expresar el nivel de la dureza en el agua es mg/L de CaCO3.
Las concentraciones de calcio y magnesio se expresan como equivalentes de CaCO3.
Se puede usar la siguiente fórmula para calcular la dureza, cuando se conocen las concentraciones de calcio y magnesio en el agua:
Dureza del agua = 2,5Ca + 4,1Mg
Donde el calcio y el magnesio se miden en ppm (1 ppm = 1 mg/L).
Por ejemplo, agua con 50 ppm de Ca y 15 ppm de magnesio tendrá dureza de:
2,5 × 50 + 4,1 × 15 = 186,5 mg/L de CaCO3.
| Dureza en mg/l de CaCo3 | Clasificación |
|---|---|
| < 60 mg/l | Blanda |
| 60 – 120 mg/l | Moderadamente dura |
| 120 – 180 mg/l | Dura |
| > 180 mg/l | Muy dura |
La eliminación de la dureza en agua se realiza usando cal o combinando con carbonato de sodio, dependiendo de la composición química del agua.
RAS – Relación de Adsorción de Sodio
La RAS es un parámetro de calidad del agua de riego que ayuda a estimar el potencial del sodio en el agua para adsorber a las partículas del suelo en relación con el calcio y el magnesio. Si se riega con agua con valores de RAS de 10 o más, el suelo podría perder su estructura y capacidad de infiltración. Esto es particularmente cierto para suelos con una concentración relativamente alta de arcilla.
La RAS se calcula de la siguiente manera:
¿Qué es la alcalinidad del agua?
La alcalinidad del agua está relacionada con el pH, pero, en realidad, es un parámetro diferente. Es una medida de la capacidad del agua para resistir los cambios en el pH o, en otras palabras, es la capacidad de amortiguación del agua. No se debe confundir «alcalinidad» con «alcalinas» (lo que significa un pH de 7,0 a 14,0).
Los principales componentes de la alcalinidad del agua son:
• Los carbonatos (CO3-2).
• Los bicarbonatos (HCO3).
• Hidróxidos solubles (OH–).
La alcalinidad se expresa normalmente como ppm o mg/L de carbonato de calcio (CaCO3). Cuanto mayor sea la alcalinidad, más ácido se puede añadir sin cambiar considerablemente el pH. Esto es debido a que los bicarbonatos (HCO3-) y carbonatos (CO3-2) reaccionan con los iones hidrógeno (H+) aportado por el ácido, evitando que caiga el pH.
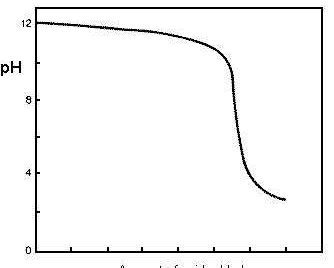
Una vez que todos los componentes de alcalinidad en el agua se neutralizan por el ácido, la concentración de los iones de hidrógeno libres en el agua aumenta y hay un dramático descenso en el pH del agua. El siguiente gráfico ilustra este «punto de ruptura», donde el pH cae: